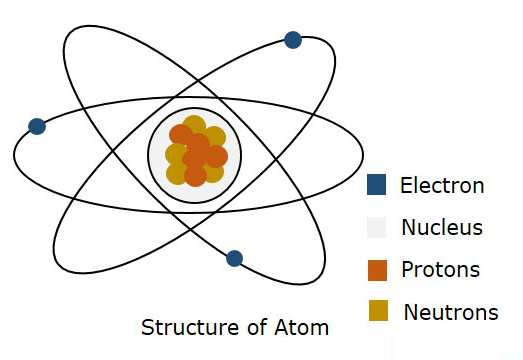
Материя состоит из молекул, которые состоят из атомов. Согласно теории Бора, «атом состоит из положительно заряженного ядра и ряда отрицательно заряженных электронов, которые вращаются вокруг ядра на различных орбитах». Когда электрон поднимается из более низкого состояния в более высокое состояние, он называется возбужденным . При возбуждении, если электрон полностью удаляется из ядра, говорят, что атом ионизирован. Итак, процесс перевода атома из нормального состояния в это ионизированное состояние называется ионизацией .
На следующем рисунке показана структура атома.
Согласно модели Бора, говорят, что электрон движется по определенной орбите , тогда как согласно квантовой механике электрон считается где-то в свободном пространстве атома, называемом орбиталью . Эта теория квантовой механики оказалась правильной. Следовательно, трехмерная граница, где электрон, вероятно, найден, называется атомной орбиталью .
Квантовые числа
Каждая орбита, по которой движется электрон, отличается своей энергией и формой. Энергетические уровни орбиталей могут быть представлены с использованием дискретного набора интегралов и половинных интегралов, известных как квантовые числа. Для определения волновой функции используются четыре квантовых числа.
Основное квантовое число
Первое квантовое число, которое описывает электрон, является главным квантовым числом . Его символ n . Он определяет размер или порядок (уровень энергии) числа. При увеличении значения n среднее расстояние от электрона до ядра также увеличивается, а энергия электрона также увеличивается. Основной энергетический уровень можно понимать как оболочку.
Квантовое число углового момента
Это квантовое число имеет символ l . Это l указывает на форму орбиты. Он варьируется от 0 до n-1.
l = 0, 1, 2… n-1
Для первой оболочки n = 1.
т. е. для n-1 l = 0 является единственно возможным значением l при n = 1.
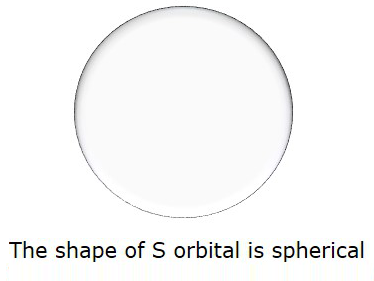
Итак, когда l = 0, он называется S- орбитальным. Форма S сферическая. Следующий рисунок представляет форму S.
Если n = 2, то l = 0, 1, поскольку это два возможных значения для n = 2.
Мы знаем, что это S-орбиталь для l = 0, но если l = 1, это P- орбиталь.
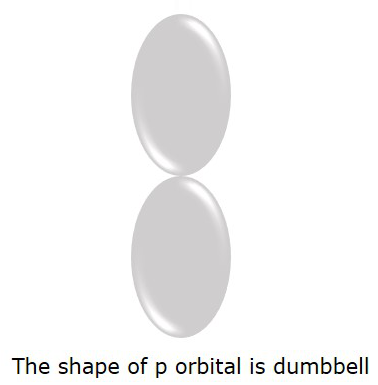
P-орбиталь, где электроны с большей вероятностью обнаружат, имеет форму гантели . Это показано на следующем рисунке.
Магнитное Квантовое число
Это квантовое число обозначается через m l, которое представляет собой ориентацию орбитали вокруг ядра. Значения m l зависят от l.
ml= int(−lto+l)
Для l = 0, m l = 0 это представляет S орбиталь.
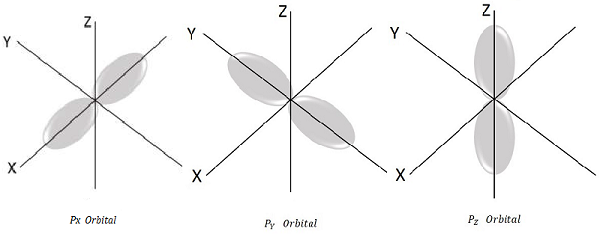
Для l = 1, m l = -1, 0, +1 это три возможных значения, и это представляет P-орбиталь.
Следовательно, у нас есть три P-орбитали, как показано на следующем рисунке.
Спин Квантовое число
Это представлено m s, и электрон здесь вращается на оси. Движение вращающегося электрона может быть либо по часовой стрелке, либо против часовой стрелки, как показано здесь ниже.
Возможные значения для этого спинового квантового числа будут как,
ms=+ frac12up
Для движения, называемого раскруткой, результат равен половине.
ms=− frac12вниз
Для движения, называемого вращением вниз, результат будет отрицательным.
Это четыре квантовых числа.
Принцип исключения Паули
Согласно принципу исключения Паули, никакие два электрона в атоме не могут иметь одинаковый набор из четырех одинаковых квантовых чисел . Это означает, что если любые два электрона имеют одинаковые значения n, s, ml (как мы только что обсуждали выше), то значение l определенно будет отличаться в них. Следовательно, никакие два электрона не будут иметь одинаковую энергию.
Электронные оболочки
Если n = 1 является оболочкой, то l = 0 является вложенной оболочкой.
Аналогично, n = 2 является оболочкой, а l = 0, 1 является подоболочкой.
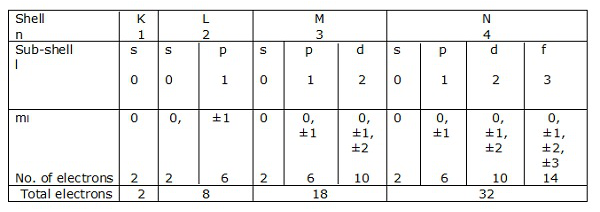
Оболочки электронов, соответствующие n = 1, 2, 3… .., представлены K, L, M, N соответственно. Подоболочки или орбитали, соответствующие l = 0, 1, 2, 3 и т. Д., Обозначены s, p, d, f и т. Д. Соответственно.
Давайте посмотрим на электронные конфигурации углерода, кремния и германия (группа IV — A).
Наблюдается, что самая внешняя p-оболочка в каждом случае содержит только два электрона. Но возможное количество электронов составляет шесть. Следовательно, в каждой внешней самой оболочке есть четыре валентных электрона . Итак, каждый электрон в атоме имеет удельную энергию. Расположение атомов внутри молекул в любом веществе почти такое же. Но расстояние между атомами отличается от материала к материалу.