Химия — Введение
Химия — это раздел естествознания, который изучает структуру, состав и изменяющиеся свойства веществ.
Химия изучает наименьшую часть вещества, то есть атома (вместе со всеми его свойствами), до крупных материалов (например, золота, серебра, железа и т. Д.) И их свойства.
Химия также изучает межмолекулярные силы (которые обеспечивают материю общие свойства) и взаимодействия между веществами посредством химических реакций.
В 1998 году профессор Раймонд Чанг определил химию как
«Химия» означает изучение материи и ее изменений.
Считается, что изучение химии началось с теории четырех элементов, предложенной Аристотелем.
Четыре теории элементов утверждают, что «огонь, воздух, земля и вода были фундаментальными элементами, из которых все формируется как комбинация».
Из-за своей классической работы, а именно «Скептический химик», Роберт Бойл известен как отец-основатель химии.
Бойл сформулировал закон, ставший популярным как «Закон Бойля».
Закон Бойля — это экспериментальный закон о газе, который анализирует взаимосвязь между давлением газа и объемом соответствующего контейнера.
Отстаивая свой закон, Бойль отверг классическую теорию «четырех элементов».
Американские ученые Линус Полинг и Гилберт Н. Льюис совместно выдвинули электронную теорию химических связей и молекулярных орбиталей.
Организация Объединенных Наций объявила 2011 год «Международным годом химии».
В химии материя определяется как все, что имеет массу и объем покоя, а также занимает пространство.
Вещество состоит из частиц.
Атом является фундаментальной единицей химии.
Атом состоит из плотного ядра, известного как атомное ядро, и он окружен пространством, известным как электронное облако .
Ядро (атома) состоит из протонов ( + 5 заряженных частиц ) и нейтронов ( нейтральных или незаряженных частиц ); вместе эти два известны как нуклоны (как показано на рисунке ниже).
Химический элемент — это чистая форма вещества; он состоит из одного типа атома.
Периодическая таблица является стандартизированным представлением всех доступных химических элементов.
Соединение — это чистая форма вещества; он состоит из более чем одного элемента.
Молекула — это самая маленькая неделимая часть чистого химического вещества; Молекула обладает отличительным набором химических свойств (см. изображение ниже).
Химия — Отрасли
-
Следующая таблица иллюстрирует разделы химии —
Следующая таблица иллюстрирует разделы химии —
| Ветка | Подотрасль | Определение |
|---|---|---|
| Физическая химия | Физическая химия | Изучение физических свойств молекул |
| Химическая кинетика | Изучение скоростей химических реакций | |
| электрохимия | Изучение взаимодействия атомов, молекул, ионов и электрического тока (т.е. перенос электрона между электродом и электролитом или частицами) | |
| Поверхностная химия | изучение химических реакций на поверхностях (веществ) | |
| термохимия | Изучить связь между химическим воздействием и количеством поглощенного тепла | |
| Квантовая химия | Исследование применения квантовой механики в физических моделях | |
| спектроскопия | Изучение спектров света или излучения | |
| фотохимия | изучение химических эффектов, вызванных светом | |
| Органическая химия | Органическая химия | Изучение структуры, свойств и подготовка химических (углеродных) соединений (например, топлива, пластмасс, пищевых добавок и лекарств) |
| стереохимия | Исследование относительного пространственного расположения атомов (в молекулах) | |
| Физическая органическая химия | изучение структуры и реакционной способности (взаимосвязи) в органических молекулах | |
| Полимерная химия | Изучение полимерных молекул (состав и создание) | |
| Металлоорганическая химия | Исследование химических веществ, которые содержат связи (особенно между углеродом и металлом) | |
| Лекарственная химия | Изучение проектирования, разработки и синтеза лекарств и лекарств | |
| Неорганическая химия | Неорганическая химия | Изучение всех материалов, которые не являются органическими (например, минералы, металлы, катализаторы, кристаллические структуры и т. Д.) |
| Металлоорганическая химия | Исследование химических соединений, содержащих связи (особенно между углеродом и металлом) | |
| Твердотельная Химия | Изучение химических соединений, содержащих связи между углеродом и металлом | |
| Ядерная химия | Исследование радиоактивных веществ | |
| Геохимия | Изучение химического состава земли (например, горных пород, минералов и атмосферы) | |
| Биоинорганическая химия | Исследование взаимодействий между ионами металлов и живой тканью | |
| Координационная химия | ||
| биохимия | биохимия | Изучение химической реакции (и изменений) у живых существ |
| Молекулярная биохимия | Изучение биомолекул наряду с их функциями | |
| Клиническая Биохимия | Изучение химических изменений в живых организмах, вызванных различными заболеваниями | |
| Молекулярная биология | Изучение различных типов биосинтеза ДНК, РНК и белков (и их взаимосвязи) | |
| Сельскохозяйственная биохимия | Изучение химии животного мира (т.е. растений) | |
| Аналитическая химия | Изучение стандартизированных экспериментальных методов в химии (т.е. количественное определение химических свойств вещества) | |
| астрохимия | Изучение реакций химических элементов и молекул, обнаруженных во Вселенной | |
| Космохимия | Изучение химического состава веществ, найденных во вселенной | |
| Экологическая химия | Изучение химических и биохимических явлений, происходящих в окружающей среде |
Химия — радиоактивность
Вступление
-
Процесс испускания частиц из ядер из-за ядерной нестабильности; известен как радиоактивность.
-
Вещество, которое выделяет такую энергию / лучи, известно как радиоактивное вещество.
-
Невидимые лучи, испускаемые таким радиоактивным веществом, известны как радиоактивные лучи.
-
Точно так же радиоактивность — это ядерное явление, которое происходит (естественно) из-за ядерной нестабильности атомов.
-
В 1896 году Анри Беккерель впервые наблюдал явления радиоактивности, но термин «радиоактивность» был придуман Марией Кюри.
-
Мария Кюри обнаружила радиоактивные элементы, а именно полоний и радий в 1898 году.
-
За свое открытие Мария Кюри получила Нобелевскую премию.
Процесс испускания частиц из ядер из-за ядерной нестабильности; известен как радиоактивность.
Вещество, которое выделяет такую энергию / лучи, известно как радиоактивное вещество.
Невидимые лучи, испускаемые таким радиоактивным веществом, известны как радиоактивные лучи.
Точно так же радиоактивность — это ядерное явление, которое происходит (естественно) из-за ядерной нестабильности атомов.
В 1896 году Анри Беккерель впервые наблюдал явления радиоактивности, но термин «радиоактивность» был придуман Марией Кюри.
Мария Кюри обнаружила радиоактивные элементы, а именно полоний и радий в 1898 году.
За свое открытие Мария Кюри получила Нобелевскую премию.
Радиоактивные лучи
-
После долгих лет эксперимента Эрнест Резерфорд вместе со своим коллегой (Гансом Гейгером и его учеником Эрнестом Марсденом) обнаружили альфа-лучи, бета-лучи и гамма-лучи.
После долгих лет эксперимента Эрнест Резерфорд вместе со своим коллегой (Гансом Гейгером и его учеником Эрнестом Марсденом) обнаружили альфа-лучи, бета-лучи и гамма-лучи.
-
Эти лучи испускаются в результате распада атомов.
Эти лучи испускаются в результате распада атомов.
Альфа (α) частицы
-
Альфа-частицы обычно состоят из двух протонов и двух нейтронов, которые тесно связаны между собой.
-
Альфа-частицы выделяются во время радиоактивного распада (или альфа-распада) из радионуклидов ядра.
-
Альфа-частицы идентичны ядру либо нормального атома гелия, либо атома гелия с двойной ионизацией.
-
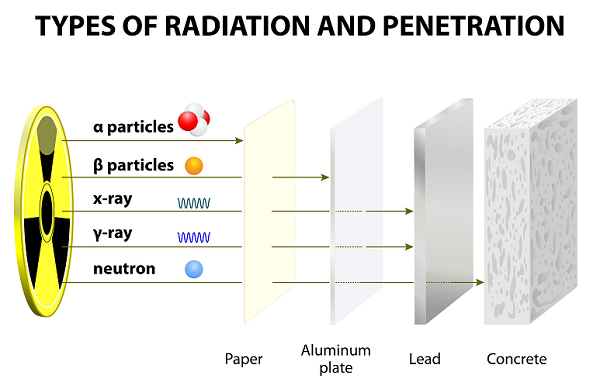
По сравнению с другими частицами (то есть гамма и бета), альфа-частицы тяжелые и медленные. Следовательно, альфа-частицы имеют очень малую дальность действия в воздухе.
-
Из-за низкой скорости альфа-частицы имеют очень слабую проникающую способность; эти частицы даже останавливаются тонким бумажным листом (см. изображение выше).
-
Из-за двойного положительного заряда альфа-частицы сильно ионизируются.
Альфа-частицы обычно состоят из двух протонов и двух нейтронов, которые тесно связаны между собой.
Альфа-частицы выделяются во время радиоактивного распада (или альфа-распада) из радионуклидов ядра.
Альфа-частицы идентичны ядру либо нормального атома гелия, либо атома гелия с двойной ионизацией.
По сравнению с другими частицами (то есть гамма и бета), альфа-частицы тяжелые и медленные. Следовательно, альфа-частицы имеют очень малую дальность действия в воздухе.
Из-за низкой скорости альфа-частицы имеют очень слабую проникающую способность; эти частицы даже останавливаются тонким бумажным листом (см. изображение выше).
Из-за двойного положительного заряда альфа-частицы сильно ионизируются.
Бета (β) частицы
-
Бета-частицы — это быстро движущиеся электроны, испускаемые некоторыми радионуклидами во время радиоактивного распада (также известного как бета-распад).
-
Бета-частицы имеют гораздо меньший вес и несут один отрицательный заряд.
-
Бета-частицы редко ионизируются, чем альфа-частицы.
-
Из-за меньшего веса бета-частицы могут перемещаться намного дальше, чем альфа-частицы; однако бета-частицы могут быть остановлены несколькими листами бумаги или одним листом алюминия.
-
Бета-частицы заряжены отрицательно и притягиваются к положительно заряженным частицам.
Бета-частицы — это быстро движущиеся электроны, испускаемые некоторыми радионуклидами во время радиоактивного распада (также известного как бета-распад).
Бета-частицы имеют гораздо меньший вес и несут один отрицательный заряд.
Бета-частицы редко ионизируются, чем альфа-частицы.
Из-за меньшего веса бета-частицы могут перемещаться намного дальше, чем альфа-частицы; однако бета-частицы могут быть остановлены несколькими листами бумаги или одним листом алюминия.
Бета-частицы заряжены отрицательно и притягиваются к положительно заряженным частицам.
Гамма (ү) частицы
-
Гамма-частицы представляют собой сгусток высокой энергии, а именно электромагнитную энергию (фотон), излучаемую радиоактивными элементами во время радиоактивного распада.
-
Среди всех трех частиц (альфа, бета и гамма) гамма-частицы являются наиболее энергичными фотонами.
-
Гамма-частицы, которые являются формой электромагнитного излучения (ЭМИ), происходят из ядра.
-
Длины волн гамма-излучения самые короткие среди всех трех.
-
Гамма-частицы не имеют заряда и являются нейтральными; поэтому на них не влияют магнитные и электрические поля.
Гамма-частицы представляют собой сгусток высокой энергии, а именно электромагнитную энергию (фотон), излучаемую радиоактивными элементами во время радиоактивного распада.
Среди всех трех частиц (альфа, бета и гамма) гамма-частицы являются наиболее энергичными фотонами.
Гамма-частицы, которые являются формой электромагнитного излучения (ЭМИ), происходят из ядра.
Длины волн гамма-излучения самые короткие среди всех трех.
Гамма-частицы не имеют заряда и являются нейтральными; поэтому на них не влияют магнитные и электрические поля.
Использование радиоактивных элементов
-
Радиоактивные элементы используются в —
-
Медицинская сфера (лечение многих заболеваний)
-
Производственный процесс
-
Производство энергии — Ядерные реакторы
-
Радиоактивные элементы используются в —
Медицинская сфера (лечение многих заболеваний)
Производственный процесс
Производство энергии — Ядерные реакторы
Химия — Ядерная энергия
Вступление
-
Ядерные реакции выделяют огромное количество энергии (известной как ядерная энергия), которая используется для производства электроэнергии на атомной электростанции.
Ядерные реакции выделяют огромное количество энергии (известной как ядерная энергия), которая используется для производства электроэнергии на атомной электростанции.
-
Ядерная энергия обычно производится ядерным делением, ядерным синтезом и ядерным распадом .
-
В 1938 году немецкие химики Отто Хан, Фриц Штрассманн и австрийский физик Лиз Мейтнер провели эксперименты, в ходе которых были получены бомбардировщики нейтронами урана. В результате этого эксперимента относительно крошечный нейтрон разделил ядро массивных атомов урана на две примерно равные части и выпустил огромную энергию.
-
Ядерные эксперименты Отто Хана и его коллег популярны как ядерное деление.
Ядерная энергия обычно производится ядерным делением, ядерным синтезом и ядерным распадом .
В 1938 году немецкие химики Отто Хан, Фриц Штрассманн и австрийский физик Лиз Мейтнер провели эксперименты, в ходе которых были получены бомбардировщики нейтронами урана. В результате этого эксперимента относительно крошечный нейтрон разделил ядро массивных атомов урана на две примерно равные части и выпустил огромную энергию.
Ядерные эксперименты Отто Хана и его коллег популярны как ядерное деление.
Ядерное деление
-
Процесс ядерного деления производит свободные нейтроны и гамма-фотоны, при этом также выделяется очень большое количество энергии.
-
Деление ядра — это экзотермическая реакция, которая может выделять большое количество энергии в форме электромагнитного излучения, а также кинетическую энергию.
-
Ядерное деление иногда может происходить естественным образом (т.е. без нейтронной бомбардировки) как вид радиоактивного распада.
Процесс ядерного деления производит свободные нейтроны и гамма-фотоны, при этом также выделяется очень большое количество энергии.
Деление ядра — это экзотермическая реакция, которая может выделять большое количество энергии в форме электромагнитного излучения, а также кинетическую энергию.
Ядерное деление иногда может происходить естественным образом (т.е. без нейтронной бомбардировки) как вид радиоактивного распада.
Типы ядерного деления
-
Ниже приведены основные типы ядерного деления —
-
Цепная реакция и
-
Реакция деления
-
Ниже приведены основные типы ядерного деления —
Цепная реакция и
Реакция деления
Давайте обсудим их вкратце —
Когда одна ядерная реакция вызывает одну или несколько последующих ядерных реакций, она называется цепной реакцией.
Такая цепная реакция увеличивает вероятность самораспространяющейся серии ядерных реакций.
Ядерные цепные реакции выделяют в миллион раз больше энергии за реакцию, чем любая другая химическая реакция; следовательно, это также известно как взрывная или неконтролируемая цепная реакция.
Когда тяжелый атом испытывает ядерное деление, он обычно распадается на два или более осколков деления. Во время процесса испускается несколько свободных нейтронов, гамма-лучей и нейтрино, и в конечном итоге выделяется большое количество энергии.
Ниже приведены два примера цепной реакции:
235 U + → нейтронные осколки деления + 2,4 нейтрона + 192,9 МэВ
235 Pu + → нейтронные осколки деления + 2,9 нейтрона + 198,9 МэВ
В атомной бомбе используется технология цепной реакции, так как она требует постоянного источника энергии.
Реакция деления, в которой нейтроны (образующиеся при делении атомов топлива) используются, чтобы вызвать еще большее деление для выделения устойчивой энергии, известна как реакции деления.
Такие реакции медленные и контролируемые; поэтому также известен как контролируемая цепная реакция.
Вырабатывающий энергию (электричество) ядерный реактор является идеальным примером управляемой цепной реакции.
На основании свойств и типа использования деление / контролируемая цепная реакция классифицируется как —
Энергетические реакторы
Исследовательские реакторы
Заводчик реакторов
Эти энергетические реакторы обычно преобразуют кинетическую энергию продуктов деления в тепло; кроме того, тепло используется для нагрева рабочей жидкости, которая приводит в действие тепловой двигатель, который в конечном итоге генерирует механическую или электрическую энергию.
Ниже приведены основные компоненты ядерного реактора.
Ядерное топливо — такое как уран ( 233 U, 235 U), торий (Th 232 ), плутоний (Pu 239 ).
Модераторы — используются для контроля испускаемых нейтронов. Например, тяжелая вода, бериллий, графит и т. Д.
Охлаждающая жидкость — используется для охлаждения реактора. Например, вода, пар, гелий, CO 2 , воздух, расплавленные металлы и т. Д.
Контрольные стержни — используются для запуска и остановки реакции деления. Например, кадмиевые или борные стержни используются для этой цели.
Процесс слияния двух легких ядер с образованием тяжелого ядра известен как ядерный синтез; во время этого процесса высвобождается огромное количество энергии, известной как ядерная энергия.
Лучший пример ядерного синтеза — водородная бомба.
Водородная бомба примерно в 1000 раз мощнее атомной.
Химия — Металлы
Материал (который может быть элементом, составом или сплавом), который является твердым, блестящим, непрозрачным и обладает способностью проводить тепло и электричество, известен как металл.
Металлы естественным образом содержатся в земной коре в нечистой форме, то есть в рудах. И это добывается в процессе добычи.
Среди всех известных 118 элементов (периодической таблицы) около 91 элемента являются металлами.
Следующее — существенные особенности металлов —
Металлы, как правило, податливы — это значит, что их форму можно постоянно менять, не ломая и не растрескивая
Металлы легкоплавкие — это значит; это может быть сплавлено или расплавлено легко.
Металлы пластичны — это значит; ему можно придать любую форму, даже тонкий лист или проволоку.
Металлы являются хорошим проводником тепла и электричества; свинец — исключение, поскольку он не несет электричество.
Металлы естественным образом реагируют с различными неметаллами и образуют соединения. Металлы могут реагировать с основаниями и кислотами. Например, 4 Na + O 2 → 2 Na 2 O (оксид натрия) и т. Д.
Сплав является продуктом смеси двух или более элементов, в которых доминирует металл.
Чтобы произвести или изготовить желаемый продукт, смешивают различные металлы (в разных соотношениях) (то есть сплавы). Например, сплавы железа, а именно нержавеющая сталь, чугун, лист из сплава и т. Д., Составляют значительную долю как по количеству, так и по коммерческой стоимости.
Металлы обычно изготавливают из сплавов с целью сделать их более устойчивыми к коррозии, менее хрупкими, придать привлекательные цвета и т. Д.
Основной металл — В химии значение основного металла — металл, который легко окисляется или подвергается коррозии, а также легко реагирует с HCl (разбавленной соляной кислотой) и образует водород. Например, железо, никель, цинк, свинец и т. Д.
Черный металл — «черный» — латинское слово, означающее вещество «содержащий железо». Например, сталь и т. Д.
Тяжелый металл . Металл, который намного плотнее, чем обычный металл, относится к категории тяжелых металлов. Тяжелые металлы токсичны или ядовиты в низких концентрациях. Например, ртуть (Hg), мышьяк (As), хром (Cr), кадмий (Cd), таллий (Tl) и свинец (Pb).
Драгоценный металл . Металлические элементы, имеющие редкий металлический химический элемент, имеющий высокую экономическую ценность, относятся к категории драгоценных металлов. Например, платина, золото, серебро, палладий и т. Д.
Благородный металл — металлы, которые устойчивы к коррозии или окислению. Например, рутений (Ru), родий (Rh), палладий (Pd) и т. Д.
Ниже приведены важные применения металлов —
Поскольку металлы являются хорошим проводником тепла и электричества; следовательно, он используется в качестве электрического провода и во многих других электрических приборах, включая электродвигатели и т. д. Например, медь, серебро, алюминий и т. д.
Тяжелые металлы используются в конструкциях мостов, бассейнов и для многих других целей.
Многие металлы используются для изготовления различных предметов домашнего обихода, таких как, посуда, кастрюли, печи и т. Д.
Металлы часто используются для изготовления многих типов инструментов, начиная от простой отвертки до тяжелого катка.
Драгоценные металлы имеют красивый внешний вид и привлекательны (например, золото, серебро и т. Д.); поэтому они используются как украшения.
Некоторый определенный металл используется для радиаторов, которые защищают чувствительное оборудование от перегрева.
Радиоактивные металлы (например, уран и плутоний) используются в производстве ядерной энергии.
Ртуть — это металл, который остается в жидкой форме при комнатной температуре; используется в термометре.
Химия — Металлургия
Отрасль науки и техники, которая изучает свойства металлов, их производство и очистку, известна как металлургия .
Встречающееся в природе твердое неорганическое вещество известно как минерал .
Встречающийся в природе твердый материал, из которого можно извлечь ценный минерал или металл, известен как руда .
Следующая таблица иллюстрирует основные элементы и их руды —
Химия — Натрий
Натрий — это мягкий, серебристый цвет и высокореактивный щелочной металл.
В периодической таблице натрий содержится в группе 1, так как он имеет один электрон в своей внешней оболочке.
Символом натрия является « Na», которое на самом деле взято из латинского слова «natrium».
С точки зрения изобилия натрий является шестым элементом, найденным в земной коре.
Натрий существует в различных минералах, включая полевые шпаты, содалит и каменную соль (NaCl).
В 1807 году Хамфри Дэви впервые выделил натрий электролизом гидроксида натрия.
К тому времени известно 20 изотопов натрия, но среди всех стабильно только 23 Na.
Следующее — главные особенности элемента натрия —
Металлический натрий мягкий элемент, который можно легко разрезать ножом.
Натрий является хорошим проводником тепла и электричества.
Из-за низкой атомной массы и большого атомного радиуса натрий является одним из наименее плотных элементов (третий наименее плотный элемент — первые два — литий и калий).
Натрий может плавать на воде.
Натрий вдоль его соединений светится желтым (см. Изображение ниже).
Соединения натрия имеют очень большое коммерческое значение и пользуются большим спросом в отраслях стекла, бумаги, мыла и текстиля.
Ниже приведены некоторые важные примеры соединений натрия:
Поваренная соль — (NaCl)
Кальцинированная сода — (Na 2 CO 3 )
Пищевая сода — (NaHCO 3 )
Сода каустическая — (NaOH)
Нитрат натрия — (NaNO 3 )
Тиосульфат натрия — (Na 2 S 2 O 3 · 5H 2 O)
Бура — (Na 2 B 4 O 7 · 10H 2 O)
Ди- и тринатрийфосфаты
Земная кора содержит около 2,27% натрия.
Натрий — 5- й самый распространенный металл; другие четыре — это алюминий, железо, кальций и магний.
В океанической воде содержится около 1,08 × 104 миллиграмма натрия на литр.
Натрий не является чистым элементом, так как он очень реактивный.
Ниже приведены основные области применения натрия —
Хлорид натрия очень полезен для защиты от обледенения и обледенения, а также в качестве консерванта.
В кулинарии используется бикарбонат натрия.
Натрий и некоторые его соединения используются в медицине.
По сравнению с калием (который является лучшим ионом), натрий используется чаще из-за его более низкой цены и атомного веса.
В органической химии гидрид натрия используется в качестве различных реакций.
Металлический натрий в основном используется для производства борогидрида натрия, трифенилфосфина натрия, азида, индиго и т. Д.
В некоторых быстрых реакторах жидкий натрий используется в качестве теплоносителя из-за его свойства хорошей теплопроводности.
Натрий также является важным минералом для здоровья человека, так как он регулирует кровяное давление, объем крови, осмотическое равновесие и значение рН.
Минимальное количество 500 мг натрия требуется каждый день для здорового человеческого организма.
Химия — Кальций
Кальций является мягким серовато-желтым щелочным элементом, встречающимся в основном в земной коре.
Символ кальция — «Ca», а атомный номер — «20».
Свободный кальций практически не существует в природе, так как он очень реактивный.
Кальций вырабатывается обычно при нуклеосинтезе сверхновых.
Кальций является одним из самых распространенных металлов по массе, найденных у многих животных.
Кальций является очень важным компонентом зубов, костей и оболочек.
Карбонат кальция и цитрат кальция являются основными пищевыми добавками, необходимыми для хорошего здоровья.
Всемирная организация здравоохранения (ВОЗ) внесла кальций в список основных лекарственных средств.
По сравнению с другими металлами ион кальция и большинство других соединений кальция обладают низкой токсичностью.
Если кальций вступает в контакт с водой или кислотой, он реагирует с ними и становится опасным.
Если кальций вступает в контакт с воздухом, он быстро реагирует и образует серо-белое покрытие из нитрида кальция и оксида кальция.
Большинство солей кальция обычно бесцветны.
Когда кальций сжигается, цвет его пламени становится кирпично-красным (см. Изображение ниже).
Металлический кальций имеет сравнительно более высокое удельное электрическое сопротивление, чем алюминий или медь.
Кальций встречается обычно в осадочных породах.
Минералы (осадочные), в которых содержится кальций, — это кальцит, доломит и гипс.
Кальций также содержится в магматических и метаморфических породах, в основном в силикатных минералах, таких как амфиболы, плагиоклазы, пироксены и гранаты.
Кальций также содержится во многих пищевых продуктах, а именно в молочных продуктах, миндале, фундуке, соевых бобах, брокколи, листьях одуванчика, инжир и во многих других.
Оксид кальция — CaO
Гидроксид кальция — Ca (OH) 2
Хлорид кальция — CaCl 2
Гипохлорит кальция (отбеливающий порошок) — Ca (ClO) 2
Фосфат кальция — Ca 3 (PO 4 ) 2
Кальций имеет широкий спектр применения, значительными из которых являются —
Карбонат кальция (CaCO 3 ) используется в производстве цемента.
Карбонат кальция (CaCO 3 ) также используется при изготовлении зубной пасты.
В инсектицидах используется арсенат кальция (Ca 3 (AsO 4 ) 2 ).
Хлорид кальция (CaCl 2 ) используется для удаления льда, а также для борьбы с пылью.
Цитрат кальция (Ca 3 (C 6 H 5 O 7 ) 2 ) обычно используется в качестве пищевого консерванта.
Глюконат кальция (Ca (C 6 H 11 O 7 ) 2 ) часто используется в качестве пищевой добавки, а также в витаминных таблетках.
Гипохлорит кальция (Ca (OCl) 2 ) обычно используется в качестве дезинфицирующего средства для бассейна, в качестве отбеливающего агента.
Химия — Алюминий
Металл с серебристо-белым, мягким, немагнитным и пластичным металлическим свойством известен как алюминий.
Алюминиевый символ — «А1», а его атомный номер — «13» .
Химический элемент алюминий относится к группе бора.
Металлический алюминий является химически активным элементом.
Алюминий обладает потенциалом противостоять коррозии, и процесс этого удельного сопротивления известен как пассивация.
Алюминий — сравнительно прочный, легкий, мягкий, ковкий и пластичный металл.
Алюминий немагнитен и не легко воспламеняется.
Алюминиевая пленка является очень хорошим отражателем видимого света, поскольку она отражает более 90 процентов входящих лучей.
Алюминий обычно реагирует с водой и образует водород.
Алюминий является металлом низкой плотности и обладает свойством противостоять коррозии.
Алюминий обладает свойством теплопроводности и электропроводности и, следовательно, является хорошим проводником.
Алюминий составляет (около) 8 процентов земной коры.
После кислорода и кремния алюминий является третьим по распространенности элементом; однако, это самый распространенный металл в коре.
Когда водород плавится с магнием, он создает стабильный алюминий.
Алюминий естественным образом содержится в оксидах или силикатах.
Ниже приведены основные соединения алюминия —
Глинозем — Al 2 O 3
Алюминий хлорид — AlCl 3
Сульфат алюминия — Al 2 (SO 4 ) 3
Гидроксид алюминия — Al (OH) 3
Карбид алюминия — Al 4 C 3
Алюминий имеет широкий спектр применения в промышленности, а также в повседневной жизни; значительные из них —
Алюминий используется в таких отраслях транспорта, как железная дорога, автомобили, самолеты, космические корабли, грузовики, морские суда, велосипеды и т. Д.
Алюминий используется в упаковке некоторых специфических материалов.
Алюминий используется в конструкциях дверей, окон, строительной проволоки, обшивки, кровли и т. Д.
Алюминий в основном используется для изготовления электрических проводов.
Алюминий используется в производстве бытовой техники и многих других предметов домашнего обихода, таких как кухонная утварь.
Алюминий используется в бейсбольных битах, часах и многих других подобных материалах.
Алюминий используется в фототехнике.
Алюминий используется в электронных приборах.
В качестве отражателя света используется алюминий, так как он является хорошим отражателем света; в основном, некоторые материалы имеют алюминиевое покрытие, специально предназначенное для отражения света.
Алюминий используется в производстве газообразного водорода по реакции с соляной кислотой.
Алюминий используется в производстве музыкальных инструментов.
Химия — Магний
Магний — это блестящий серый твердый элемент.
Символ магния — «Mg», а атомный номер — « 12».
Китай, занимающий около 80% мирового рынка, является крупнейшим поставщиком магния.
Плотность магния составляет две трети плотности алюминия.
Среди всех щелочных металлов Земли магний имеет самую низкую температуру плавления (т.е. около 1 202 0 F) и самую низкую температуру кипения (около 1 994 0 F).
Магний обычно реагирует с водой при комнатной температуре.
Иногда магний также используется в качестве воспламенителя для термитов.
Магний, когда горит на воздухе, излучает ярко-белый свет, который также включает в себя сильные ультрафиолетовые волны.
Магний, когда горит, производит интенсивный яркий и белый свет (см. Изображение выше).
По массе магний является восьмым наиболее распространенным элементом в земной коре.
Магний обычно содержится в крупных месторождениях магнезита, доломита и других подобных минералов.
Растворимый ион магния находится в минеральной воде.
После натрия и хлора магний является третьим наиболее распространенным элементом, растворенным в морской воде.
Магний в природе встречается только в сочетании с некоторыми другими элементами.
По массе магний является 11- м наиболее распространенным элементом в организме человека и необходим для всех клеток и ферментов.
Ионы магния часто взаимодействуют с полифосфатными соединениями, включая АТФ, ДНК и РНК.
Ниже приведены основные соединения магния —
Карбонат магния — MgCO 3
Хлорид магния — MgCl 2
Цитрат магния — C 6 H 6 MgO 7
Гидроксид магния — Mg (OH) 2
Оксид магния — MgO
Сульфат магния — MgSO 4
Гептагидрат сульфата магния — (MgSO 4 · 7H 2 O)
Гептагидрат сульфата магния обычно известен как английская соль .
Магний имеет широкий спектр применения в нашей жизни; Однако некоторые значительные применения магния —
После железа и алюминия магний является третьим наиболее часто используемым элементом.
Магний особенно используется в сверхпрочных, легких материалах и сплавах.
Магний также используется в качестве материалов двигателя в авиационной промышленности.
Магний также используется для очистки растворителей; например, при приготовлении суперсухого этанола.
Многие крупные автомобильные бренды, в том числе Mercedes, Porsche, BMW, Volkswagen, Chevrolet и др., Используют магний в производстве своих высококачественных автомобилей.
Из-за низкого веса и хороших электрических и механических свойств магний обычно используется в производстве ноутбуков и планшетных компьютеров, мобильных телефонов, фотоаппаратов и многих других электронных компонентов.
Сульфит магния обычно используется в производстве бумаги.
Химия — Маганский
Марганец — это химический элемент, который обычно содержится в сочетании с железом.
Символ марганца — «Mn», а атомный номер — « 25».
Марганец — это металл, очень важный для промышленного использования.
В 1774 году Йохан Готлиб Ган впервые выделил нечистый образец металлического марганца в 1774 году.
Ниже приведены основные характеристики и характеристики марганца —
Подобно железу, марганец является серебристо-серым металлом.
Марганец может быть легко окислен, но его очень сложно расплавить, так как он очень твердый и ломкий.
В воздухе марганец медленно тускнеет (окисление).
Марганец является элементом, входящим в группу железа.
Марганец является 12- м наиболее распространенным элементом земной коры.
Почва обычно содержит около 7–9000 промилле марганца в среднем 440 промилле.
Морская вода содержит только около 10 промилле марганца; тогда как атмосфера содержит около 0,01 мкг / м3.
Пиролузит (MnO 2 ) является наиболее важной рудой марганца.
Ниже приведены основные соединения марганца —
Марганец (II) оксид — MnO
Марганец (I) оксид — Mn 2 O 3
Диоксид марганца — MnO 2
Марганец хлористый — MnCl 2
Перманганат калия — KMnO 4
Марганец (II) сульфат — MnSO 4
Марганец (II) карбонат — MnCO 3
Сульфид марганца (II) — MnS
Марганец (II) нитрат — Mn (NO 3 ) 2
Марганец (II) бромид — MnBr 2
Гептоксид марганца — Mn 2 O 7
Димарганец декакарбонил — C 10 O 10 Mn 2
Марганец (II) иодид — MnI 2
Марганец (II) фторид — MnF 2
Ниже приведены основные области применения марганца —
Марганец является одним из важнейших компонентов производства стали.
Марганцевое фосфатирование обычно используется для предотвращения ржавчины и коррозии стали.
В биологии ионы марганца (II) действуют как кофакторы для большого разнообразия ферментов.
Марганец также играет важную роль в феномене фотосинтеза растений, выделяющих кислород.
Диоксид марганца также используется при производстве кислорода и хлора, а также при сушке черных красок.
Химия — Железо
Железо является наиболее распространенным элементом, встречающимся в основном как во внешнем, так и во внутреннем ядре Земли.
Символ железа — «Fe», а атомный номер — « 26».
Железо является одним из самых ранних известных элементов, которые используются людьми.
Ниже приведены основные характеристики железа —
Элемент из чистого железа мягкий, пластичный и податливый.
Температура кипения железа находится в диапазоне от 1533 ° С до 2450 ° С.
Железо легко притягивается к магниту.
В сухом воздухе железо остается неактивным и не реагирует (с воздухом); однако во влажном воздухе он реагирует и образует ржавчину.
Чистое железо обычно не реагирует с чистой водой; однако, это легко реагирует с обычной загрязненной водой и формами ржавчины.
Железо реагирует с галогеном и серой с образованием галогенида и сульфида соответственно.
Внутренние и внешние ядра Земли в основном состоят из железа и никеля.
Скорее всего, железо является наиболее распространенным элементом земли; тем не менее, это четвертый наиболее распространенный элемент коры.
Ниже приведены основные типы железа —
Гематит — Fe 2 O 3
Магнетит — Fe 3 O 4
Сидерит — FeCO 3
Ниже приведены основные соединения железа —
Оксид железа (II) — FeO
Хлорид железа (III) — FeCl 3
Оксид-гидроксид железа (III) — Fe (ОН) 3
Сульфид железа (II) — FeS
Хлорид железа (II) — FeCl 2
Фосфат железа — FePO 4
Феррат (VI) — (FeO 4 ) 2-
Ацетат железа (II) — Fe (C 2 H 3 O 2 ) 2
Сульфид железа (III) — Fe 2 S 3
Хромат железа (III) — Fe 2 (CrO 4 ) 3
Гидроксид железа (II) — Fe (OH) 2
Ацетат железа (III) — C 14 H 27 Fe 3 O
Оксалат железа (II) — FeC 2 O 4
Фторид железа (II) — FeF 2
Из всех металлов наиболее широко используется железо (около 90 процентов мирового производства металла).
В большинстве отраслей тяжелой промышленности железо является наиболее важным элементом.
Отрасли, такие как железная дорога, судостроение, автомобилестроение, машиностроение и т. Д., Везде — железо необходимо.
Химия — Медь
Медь — это мягкий, пластичный и ковкий металл.
Медь обладает очень высокой термической и электрической проводимостью.
Символ меди — «Cu», а атомный номер — « 29».
Медь известна людям с (о) в. 8000 г. до н.
Медь является первым металлом, который был выплавлен из руды около с. 5000 г. до н.
Медь была первым металлом, который отлил в форму (в форме).
Медь была первым металлом, который был успешно легирован другим металлом, например, медью, легированной оловом, и в результате была получена бронза. Это сделано около ц. 3500 г. до н.
Первый металл, специально предназначенный для легирования другим металлом, оловом, для создания бронзы, c. 3500 г. до н.
Медь имеет естественный красновато-оранжевый цвет; это видно, как только его поверхность выставлена.
Медь является очень хорошим проводником электричества и тепла.
Медь является элементом группы 11 периодической таблицы.
Медь обычно не реагирует с водой; однако он медленно реагирует с атмосферным кислородом и образует слой коричнево-черного оксида меди.
Коричнево-черный оксид меди обычно защищает нижележащий металл от дальнейшей коррозии, подобно пассивации.
Пассивация — это процесс использования легкого слоя защитного материала, такого как оксид металла, который используется для создания защитной оболочки от коррозии.
Медь обычно находится в земной коре.
В 1857 году была обнаружена самая большая масса элементарной меди (весом около 420 тонн). Он был найден на полуострове Кьюнио в штате Мичиган, США.
Металлические сплавы, в которых медь является основным компонентом, известны как медные сплавы.
Медные сплавы обладают высокой устойчивостью к коррозии.
Лучшим (традиционным) примером медного сплава является бронза (изготовленная путем смешивания олова и латуни).
Ниже приведены основные сплавы меди —
латунь
бронза
Auricupride
Китайское серебро
Коринфская бронза
Электрум, Зеленое золото
Серое золото
чернь
Panchaloha
Розовое, красное и розовое золото
Spangold
Shibuichi
Тибетское серебро
белое золото
Ниже приведены основные соединения меди —
Ацетат меди — Cu (CH 3 COO) 2
Оксид меди (I) — Cu 2 O
Оксид меди (II) — CuO
Хлорид меди (II) — CuCl 2
Дикоппер хлорид тригидроксид — Cu 2 (OH) 3 Cl
Хлорид меди (I) — CuCl
Медь (II) нитрат — Cu (NO 3 ) 2
Цианид меди — CuCN
Медь в основном используется для изготовления электрических проводов.
Медь используется в электродвигателях.
Медь используется в кровельной, сантехнической и многих других отраслях промышленности.
Медная краска используется при покраске лодок и многих других материалов.
Многие бытовые приборы состоят из чистой меди или ее сплавов.
Химия — Серебро
Серебро — это мягкий, блестящий переход и белый металл.
Серебро обладает самой высокой электрической и теплопроводностью; и он также имеет самую высокую отражательную способность из всех металлов.
Символ серебра — «Ag», а атомный номер — « 47».
Серебро — это драгоценный металл, который давно используется людьми.
Серебро является элементом группы 11 периодической таблицы.
Серебро имеет превосходный белый металлический блеск, обычно используемый в высокой степени блеска.
Как серебро не имеет цвета; следовательно, он имеет высокую отражательную способность (света).
Серебро обладает очень высокой электрической и теплопроводностью. Его электропроводность самая высокая — выше, чем у меди.
Среди всех металлов серебро также имеет самое низкое контактное сопротивление.
Металлическое серебро обычно находится в земной коре в чистом виде.
Серебро также найдено как сплав с золотом и некоторыми другими металлами.
Серебро также содержится в некоторых минералах, таких как аргентит и хлораргирит.
Серебро в основном производится как побочный продукт из золота, меди, цинка, свинца и т. Д.
Ниже приведены основные сплавы серебра —
Argentium серебро
Британия серебро
Доре слиток
Электрум
Goloid
Платиновый стерлинг
Серебро 925 пробы
Тибетское серебро
Ниже приведены основные соединения серебра —
Хлорид серебра — AgCl
Серебро йодистое — Agl
Бромид серебра — AgBr
Оксид серебра — Ag 2 O
Сульфид серебра — Ag 2 S
Фторид серебра — AgF
Цианид серебра — AgCN
Карбонат серебра — Ag 2 CO 3
Ацетат серебра — AgC 2 H 3 O 2
Сульфат серебра — Ag 2 SO 4
Хромат серебра — Ag 2 CrO 4
Оксалат серебра — Ag 2 C 2 O 4
Хлорат серебра — AgClO 3
Ниже приведены основные области применения серебра —
С древних времен серебро использовалось для изготовления монет.
Серебро также используется при изготовлении украшений.
Многие из домашних горшков и другой посуды также использовались для изготовления серебра.
Серебро также используется в медицине, так как оно используется в качестве антибиотиков в медицинских устройствах.
Из-за очень высокой электропроводности серебро обычно используется в некоторых электронных устройствах.
Кроме того, серебро используется во многих других областях, таких как фотография, химическое оборудование, наночастицы и т. Д.
Химия — золото
Золото — это яркий, красновато-желтый, мягкий, плотный, пластичный и пластичный металл, который естественным образом содержится в земной коре.
Символ золота — «Ау», а атомный номер — « 79».
Золото (химически) является переходным металлом и относится к группе 11 периодической таблицы.
Золото, которое остается в твердом состоянии при стандартных условиях, является наименее реакционноспособным элементом.
Золото устойчиво к большинству кислот.
Золото растворяется в царской водке; царская водка представляет собой смесь азотной кислоты и соляной кислоты.
Однако золото не растворяется в азотной кислоте.
Золото обычно растворяется в щелочных растворах цианида.
Растворы цианидов широко используются в горной промышленности и гальванике.
Золото также растворяется в ртути и образует «сплавы амальгамы».
Золото не реагирует с кислородом при любой температуре.
Золото обычно встречается как свободный элемент, то есть в естественной форме.
Золото встречается в виде самородков или же встречается в породах, зернах, жилах и некоторых других аллювиальных отложениях.
Золото также встречается в форме твердого раствора с природным элементом, таким как серебро (как электрум).
В некоторых местах золото также естественно легируется медью и палладием.
Ниже приведены основные сплавы золота —
Цветное золото
Корона золото
Электрум
Розовое золото
тумбага
белое золото
Ниже приведены основные соединения золота —
Золото (III) хлорид — AuCl 3
Золото (I) хлорид — AuCl
Цианид — CN
Хлористоводородная кислота — HAuCl 4
Золото (III) оксид — Au 2 O 3
Золотой бромид — AuBr
Царская водка — HNO 3 + 3HCl
Золотой бромид — AuBr 3
Гидроксид золота (III) — AuH 3 O 3
Фторид золота — AuF 3
Золото (V) фторид — AuF 5
Сульфид золота — Au 2 S
Молниеносное золото
Золотые соли
Золотой гептафторид
Золото является одним из древнейших элементов, которые человек использовал на протяжении тысячелетий.
Так как это очень ценно и обеспечивает красивый вид, следовательно, оно характерно для изготовления украшений.
Согласно последней тенденции (в мире), около 50% золота используется для изготовления ювелирных изделий, 40% используется для инвестиций, а оставшиеся 10% используются в промышленности.
Химия — платина
Платина является податливым, пластичным, плотным и крайне нереакционноспособным химическим элементом.
Символ платины — «Pt», а его атомный номер — « 78».
Название платины происходит от испанского термина, то есть «платина», что означает « мало серебра ».
Платина — самый ценный и редкий металл (элемент) на земле.
Ниже приведены важные характеристики платины —
Платина — это серебристо-белый металл.
Платина является элементом группы 10 периодической таблицы.
Платина является одним из самых редких элементов в земной коре.
Платина является одним из наименее реактивных элементов.
Платина имеет шесть природных изотопов.
Платина является одним из самых ценных и драгоценных металлов.
Платина характерно противостоит коррозии в любых условиях. По этой причине он считается благородным металлом.
Платина обычно нерастворима в азотной и соляной кислотах, но растворяется в горячей царской водке .
После растворения в горячей царской водке платина дает водную хлорплатиновую кислоту (см. Изображение ниже).
Платина обычно встречается как природная (природная) платина и как сплав с другой платиновой группой.
Платина обычно встречается в рудах никеля и меди.
Платина также естественным образом встречается в аллювиальных песках (обычно встречается в реках).
Платина встречается с концентрацией только (около) 0,005 ppm в земной коре.
Платина-иридий является одним из наиболее значительных сплавов платины.
Ниже приведены основные соединения платины —
Хлорид платины (II) — Pt Cl 2
Платина (IV) хлорид — PtCl 4
Катализатор Адама — PtO 2
Гексафторид платины — PtF 6
Калия тетрахлоропла — K 2 PtCl 4
Соль Крогманна — K 2 Pt (CN) 4 Br
Хлороплатиновая кислота — H 2 PtCl 6
Гексахлоропл натрия — Na 2 PtCl 6
Царская водка — HNO 3 + 3HCl
сатраплатин
недаплатин
пикоплатин
Платина используется в основном для устройств контроля выбросов автомобилей.
Платина используется в нефтепереработке и многих других химических производствах.
Платина используется в электронных устройствах, таких как жесткие диски (накопители).
Платина также используется в ювелирном деле.
Помимо всего этого, платина также используется в медицине (противораковые препараты), стекловаренном оборудовании, электродах, турбинных двигателях, инвестициях и т. Д.
Химия — Цинк
В периодической таблице цинк является первым элементом группы 12.
Символ цинка — «Zn», а атомный номер — « 30».
С точки зрения доступности, цинк является 24- м наиболее распространенным элементом, найденным в земной коре, и он имеет пять стабильных изотопов.
Наиболее распространенной цинковой рудой является сфалерит (цинковая обманка), который является минералом сульфида цинка.
Андреас Сигизмунд Маргграф, немецкий химик, впервые открыл чистый металлический цинк в 1746 году.
Интересно, что алхимики сжигали цинк в воздухе и образовывали что-то другое, и они называли эту «философскую шерсть» или « белый снег ».
Цвет цинка голубовато-белый, блестящий и диамагнитный металл.
Металлический цинк обычно твердый и хрупкий; однако при повышении температуры от 100 ° С она становится податливой.
Когда температура повышается до 210 ° С, металлический цинк снова становится хрупким и может быть легко измельчен путем взбивания.
Цинк является проводником электричества.
Цинк обычно встречается в сочетании с некоторыми другими основными металлами, такими как медь и свинец.
Сфалерит — это форма сульфида цинка, и это наиболее добываемая руда.
Сфалерит содержит от 60 до 62% цинка.
Ниже приведены основные сплавы цинка —
латунь
Никель серебро
Немецкое серебро
Ниже приведены основные соединения цинка —
Оксид цинка — ZnO
Сульфид цинка — ZnS
Галогениды цинка — ZnF 2
Нитрат цинка — Zn (NO 3 ) 2
Хлорат цинка — Zn (ClO 3 ) 2
Сульфат цинка — ZnSO 4
Фосфат цинка — Zn 3 (PO 4 ) 2
Цинк молибдат — ZnMoO 4
Хромат цинка — ZnCrO 4
Арсенит цинка — Zn (AsO 2 ) 2
Ацетат цинка — Zn (O 2 CCH 3 ) 2
Цинк является одним из важнейших элементов общественного здравоохранения.
Цинк широко используется в качестве антикоррозионного агента и покрытия из железных и стальных материалов.
Цинк обычно используется в качестве анода или топлива воздушно-цинковой батареи.
Оксид цинка широко используется в качестве белого пигмента (см. Изображение ниже) в красках.
Оксид цинка также используется в качестве катализатора при производстве резины.
Цинк является существенно необходимым элементом для нашего здоровья; обычно его используют в качестве дополнительных материалов в таких формах, как оксид цинка, ацетат цинка или глюконат цинка.
Цинк, как правило, является антиоксидантом.
Дефицит цинка в организме человека может вызвать серьезные депрессивные расстройства.
После травмы цинк используется для ускорения процесса заживления.
Цинк пиритион обычно используется в шампунях для предотвращения перхоти.
Хелатный цинк обычно используется в зубных пастах и жидкостях для полоскания рта (жидкости), так как он предотвращает неприятный запах изо рта.
Цинк также защищает кожу от солнечных ожогов, поэтому его используют в лосьонах для тела.
Химия — Меркурий
Ртуть — это химический элемент, который обычно называют ртутным серебром .
Раньше ртуть была названа « гидраргирам» .
Символ ртути — «Hg», а атомный номер — « 80».
Красный пигментный киноварь добывают путем измельчения натуральной киновари или синтетического сульфида ртути.
Меркурий — это тяжелый и серебристо-белый металл.
Меркурий обычно доступен в жидком состоянии; в нормальных условиях только несколько металлических элементов остаются в жидком состоянии при комнатной температуре.
Ртуть — плохой проводник тепла, но это хороший проводник электричества.
Температура замерзания ртути составляет -38,83 ° С, а температура кипения составляет 356,73 ° С.
Отравление ртутью, вызванное употреблением любой формы ртути. Это также вызвано вдыханием паров ртути.
Ртуть растворяет многие металлы, включая золото и серебро, образуя амальгамы.
Меркурий является одним из самых редких элементов в земной коре.
Самые богатые ртутные руды содержат около 2,5 процента ртути (в пересчете на массу).
Ртуть встречается либо в качестве природного (природного) элемента, либо в кордероитных, киноварных, живущих минералах и т. Д.
Меркурий находится в области молодого горного пояса; пояс, который продолжает заставлять более плотные камни к земной коре. Например, вулканическая область или даже области горячего источника.
Амальгама является основным сплавом ртути.
Ниже приведены основные соединения Меркурия —
Хлорид ртути (II) — HgCl 2
Ртуть (II) оксид — HgO
Сульфид ртути — HgS
Меркурий (I) — хлорид — Hg 2 Cl 2
Диметилмер — C 2 H 6 Hg
Ртуть (II) нитрат — Hg (NO 3 ) 2
Ртуть (II) ацетат — C 4 H 6 O 4 Hg
Сульфат ртути (II) — HgSO 4
Меркурий (I) йодид — Hg 2 I 2
Селенид ртути — HgSe
Меркурий (II) фульминат — Hg (CNO) 2
Меркурий (II) бромид — HgBr 2
Меркурий (II) йодид — HgI 2
Ртуть (I) оксид — Hg 2 O
Ртуть (I) фторид — Hg 2 F 2
Ртутный амидохлорид — ClH 2 HgN
Диэтилртуть — C 4 H 10 Hg
Амальгама натрия
нитромерзол
Ртуть в основном используется в химической промышленности.
Меркурий используется в электротехнике и электронике.
Ртуть используется в термометрах, которые мы используем для измерения температуры.
Ртуть вместе с ее соединениями обычно используется в различных лекарствах.
Химия — Плутоний
Плутоний в основном является актинидным металлом и выглядит как серебристо-серый.
Элемент, чей атомный номер находится в диапазоне от 89 до 103, известен как актинидный элемент.
Символ плутония — «Pu», а атомный номер — « 94».
Плутоний обычно обладает шестью аллотропами.
Плутоний назван в честь Плутона .
Плутоний был впервые обнаружен в 1940 году группой ученых, а именно Гленн Т. Сиборг, Джозеф У. Кеннеди, Эдвин М. Макмиллан и Артур Уолл.
Плутоний является радиоактивным химическим элементом.
Плутоний при контакте с воздухом тускнеет, а при окислении образует матовое покрытие.
Плутоний реагирует со многими элементами, включая галогены, азот, углерод, кремний и водород.
В результате процесса деления нейтроны высвобождаются и превращают ядра урана-238 в плутоний-239.
Плутоний-239 и плутоний-241 оба являются делящимися, и, следовательно, они могут выдерживать ядерную цепную реакцию. Это очень хорошо применимо в ядерном оружии и ядерных реакторах.
Температура плавления плутония составляет 640 ° С, а его температура кипения составляет 3228 ° С.
Высвобождение ядра гелия (высокая энергия) является наиболее распространенной формой радиоактивного распада плутония.
Плутоний естественным образом встречается только в следовых количествах в урановых отложениях.
Плутоний также извлекается путем сжигания урана (при разработке ядерной энергии).
Ниже приведены основные сплавы плутония —
Плутоний-галлий является одним из важных сплавов как плутония, так и галлия.
Плутоний-галлий используется в ямах ядерного оружия.
Плутоний-галлий обладает свойством очень низкого теплового расширения.
Некоторые другие сплавы плутония —
Плутоний-алюминий
Плутоний-галлий-кобальт
Плутоний-цирконий
Плутоний-церий
Плутониево-урановый
Плутоний-уран-титан
Торий-уран-плутониевого
Оксид плутония (IV) — PuO 2
Плутония (III) хлорид — PuCl 3
Тетрафторид плутония — PuF 4
Плутоний (III) фторид
Гексафторид плутония
Гидрид плутония
Карбид плутония
Бориды плутония
Изотоп плутоний-239 является одним из важных элементов в разработке ядерного оружия.
Плутоний используется в качестве топлива на атомных электростанциях.
Химия — Уран
Уран является металлом серии актинидов периодической таблицы.
Символ урана — «U», а атомный номер — « 92».
В 1789 году Мартин Генрих Клапрот открыл элемент уран и назвал его в честь имени Урана.
Уран — серебристо-белый металл.
Атом урана имеет 92 электрона, а также 92 протона, из которых 6 являются валентными электронами.
Из-за нестабильных изотопов уран является слабым радиоактивным элементом.
Уран-238 является наиболее распространенным изотопом урана.
Уран встречается в природе в очень низких концентрациях, то есть в порциях, почве и воде.
Уран распадается постепенно (медленно), испуская свою альфа-частицу.
Уран имеет плохую электропроводность (поэтому плохой проводник электричества).
Уран податлив, пластичен и немного парамагнитен
Уран (естественно) встречается в виде урана-238, урана-235 и урана-234.
Период полураспада урана-238 составляет около 4,47 миллиардов лет, почти возраст Земли, а период полураспада урана-235 составляет около 704 миллионов лет.
Ниже приведены основные сплавы урана —
Staballoy
Гидрид урана
Ниже приведены основные соединения урана —
Нитрид урана — U 2 N 3
Пентафторид урана — UF 5
Карбид урана — UC
Уранилфторид — UO 2 F 2
Диоксид урана — UO 2
Гексафторид урана — UF 6
Оксид триурана — U 3 O 8
Тетрафторид урана — UF 4
Триоксид урана — UO 3
Четыреххлористый уран — Ucl 4
Уранилнитрат — UO 2 (NO 3 ) 2
уранила
Уранинит
Аммоний диуранат
гексафторид
Гексахлорид урана
Уран (III) йодид
Уранилацетат
Уран используется в качестве источника энергии на атомных подводных лодках (особенно в военных).
Уран используется в создании ядерного оружия.
Уран также используется в качестве балласта для судов.
Химия — свинец
Свинец является тяжелым химическим элементом (металлом), то есть имеет высокую плотность.
Символ свинца — «Pb», а атомный номер — « 82».
Свинец имеет тенденцию связывать себя; аналогично, он может образовывать цепочки, связи, кольца и многогранные структуры.
Свинец мягкий и ковкий металл; он имеет относительно низкую температуру плавления.
Свинец является относительно нереакционноспособным элементом и имеет тенденцию к образованию заветной связи.
Когда свинец режется, появляется голубовато-белый оттенок.
Во время горения свинец дает голубовато-белое пламя (см. Изображение ниже).
Соединения свинца обычно находятся в степени окисления +2.
Свинец известен доисторическим людям Западной Азии.
Свинец находится в земной коре; это редко встречается глубоко под землей.
Свинец обычно находится в сочетании с серой.
Галена — основной свинецсодержащий минерал, в основном встречающийся в цинковых рудах.
Ниже приведены основные сплавы свинца —
Молибдохалкос (медь)
Припой (жесть)
Терне (жесть)
Ниже приведены основные соединения свинца —
Окись свинца — PbO
Диоксид свинца — PbO 2
Свинец использовался для изготовления пуль в течение сотен лет.
Свинец обычно используется в качестве защитной оболочки для подводных кабелей (только потому, что он обладает свойством коррозионной стойкости).
Свинцовые листы также используются в качестве архитектурных металлов, особенно в кровельных материалах.
Свинец также используется в кислотных батареях.
Соединения свинца обычно используются в качестве красителей и полупроводников.
Соединения свинца также используются в пластике, свечах, стекле и т. Д.
Свинец обычно используется в поливинилхлориде (т.е. используется для покрытия электрических шнуров).
Присутствие свинца (в чрезмерном качестве) в организме может привести к серьезным повреждениям мозга и почек; наконец, это может даже привести к смерти.
Химия — торий
Торий является одним из радиоактивных актинидных металлов, которые встречаются в природе в больших количествах.
Символ тория — «Th», а атомный номер — « 90».
В 1829 году норвежский минералог Мортен Трейн Эсмарк впервые открыл торий.
Йенс Якоб Берцелиус, шведский химик, определил и назвал его «торий» по имени «Тор», норвежского бога грома.
Торий — это парамагнитный и мягкий радиоактивный актинидный металл.
Цвет металлического тория серебристый; когда он подвергается воздействию воздуха, он тускнеет и образует двуокись.
Все изотопы тория нестабильны и являются слабым радиоактивным элементом.
Среди всех значительных радиоактивных элементов период полураспада тория самый длинный, то есть около 14,05 миллиардов лет.
Температура плавления тория составляет около 1750 ° С.
Торий — изначальный элемент, существовавший в его нынешнем виде, существовавший еще до образования Земли.
Торий, найденный в земной коре, очищен от монацитовых песков.
Монацит, который встречается в больших количествах по всему миру, является наиболее важным источником тория.
Маг-Тор и торий-алюминий являются наиболее значительными сплавами тория, магния и алюминия.
Ниже приведены основные соединения тория —
Диоксид тория — ThO 2
Сульфид тория (IV) — ThS 2
Торий (IV) йодид — ThI 4
Тетрафторид тория — ThF 4
Торий (IV хлорид — ThCl 4
Торий (IV) Карбид — ТЬС
Некоторые другие —
торит
Торий (IV) нитрат
Торий (IV) ортосиликат
Торий обычно используется в газовой вольфрамовой дуговой сварке (GTAW), поскольку он (торий) повышает жаропрочность вольфрамовых электродов и, соответственно, улучшает стабильность дуги.
В электронном оборудовании нанесение ториевого покрытия на вольфрамовую проволоку увеличивает эмиссию электронов от нагретых катодов.
В химической промышленности обычно используется диоксид тория, а именно « торий » .
Химия — Водород
В периодической таблице водород является самым легким элементом, его атомный вес составляет всего 1,008.
Символ водорода — «Н», а атомный номер — «1».
В начале 16 века газообразный водород был впервые искусственно получен в результате реакции кислот и металлов.
Генри Кавендиш впервые признал газообразный водород отдельным веществом в период 1766-81 гг., Так как он производит воду при сжигании.
В своем плазменном состоянии не оставшиеся звезды в основном состоят из водорода.
При стандартной температуре и давлении водород выглядит бесцветным, безвкусным, без запаха, неметаллическим, нетоксичным и легко воспламеняющимся двухатомным газом.
Молекулярная формула водорода H 2 .
На земле водород существует в молекулярных формах, например, в воде или других органических соединениях.
Водород также играет важную роль в кислотно-основных реакциях.
Газообразный водород легко воспламеняется в воздухе.
Чистое водородно-кислородное пламя излучает ультрафиолетовое излучение; Кроме того, при высоком содержании кислорода они почти не видны невооруженным глазом.
Водород может реагировать практически с каждым окисляющим элементом.
При комнатной температуре водород обычно самопроизвольно и яростно реагирует с хлором и фтором и образует соответствующие галогеноводороды.
Состоящий примерно из 75 процентов всей барионной массы, водород является наиболее распространенным химическим веществом во Вселенной.
Во всей вселенной водород обычно находится в атомном и плазменном состояниях; однако свойства довольно сильно отличаются от свойств молекулярного водорода.
На земле водород существует в виде двухатомного газа, то есть H 2 .
Благодаря легкому весу водород легко выходит из земной атмосферы.
Водород является третьим наиболее распространенным элементом, найденным на поверхности Земли, но в основном в форме углеводородов и воды.
Ниже приведены основные соединения водорода —
Вода — H 2 O
Аммиак — NH 3
Хлористый водород — HCl
Фтористый водород — HF
Сероводород — H 2 S
Метан — СН 4
Гидроксид — ОН —
Бромистый водород — HBr
Йодистый водород — HI
Цианистый водород — HCN
Фосфин — PH 3
Селенид водорода — H 2 Se
Метанол — СН 3 ОН
Гидрид лития — LiH
Бикарбонат — HCO 3
Теллурид водорода — H 2 Te
Жидкий водород — H 2
Цианид — CN
Гидрид кальция — CaH 2
Тяжелая вода — D 2 O
Диборан — B 2 H 6
Гидрид натрия — NaH
Гидрид калия — KH
Наибольшее количество H 2 используется при переработке ископаемого топлива, а также при производстве аммиака.
Водород (H 2 ) широко используется в нефтяной и химической промышленности.
Н 2 обычно используется в качестве гидрирующего агента, особенно при повышении уровня насыщения ненасыщенных жиров и масел.
H 2 также используется в качестве защитного газа в сварочных процедурах, таких как атомно-водородная сварка и т. Д.
Химия — Гелий
Гелий является вторым самым легким (после водорода) и вторым по распространенности элементом во вселенной.
Символ гелия — «Он», а атомный номер — «2».
В периодической таблице гелий является первым в группе благородных газов.
Гелий назван в честь греческого бога Солнца, Гелиос .
Гелий — это бесцветный, без запаха, без вкуса, инертный, нетоксичный и одноатомный газ.
Температура кипения (-268,9 0 С) гелия является самой низкой среди всех элементов.
Гелий обычно состоит из двух электронов на атомных орбиталях и окружен ядром, которое состоит из двух протонов и двух нейтронов.
Большая часть гелия, найденного во вселенной, принадлежит гелию-4 , и считается, что он образовался во время Большого взрыва.
Большая часть нового гелия обычно создается в результате ядерного синтеза водорода в звездах, включая Солнце.
Хотя существует постоянное создание нового гелия; тем не менее, доступность гелия на земле существенно низка, поскольку, будучи легковесным элементом, он легко уходит в космос.
В гетеросфере (внешней атмосфере) Земли гелий является одним из наиболее распространенных элементов (газов).
В земной коре гелий обычно содержится в большом количестве в минералах урана и тория.
Ниже приведены основные соединения гелия —
Динатрий гелид — Na 2 He
Cristobalite He II (Силикаты) — SiO 2 He
Дигелий арсенолит — As 4 O 6 • 2He
Существует около девяти известных изотопов гелия, но следующие два являются наиболее стабильными изотопами —
Гелий-3 и
Гелий-4
Из-за низкой плотности, низкой температуры кипения, низкой растворимости, высокой теплопроводности, гелий является широко используемым элементом; Самый популярный пример — использование гелия в баллоне.
Основной кусок гелия имеет криогенное применение, такое как охлаждение сверхпроводящих магнитов, используемых в медицинских МРТ-сканерах и ЯМР-спектрометрах.
Гелий также используется в качестве защитного газа при выращивании кристаллов кремния и германия.
Гелий также используется в газовой хроматографии и в производстве титана и циркония.
Гелий используется в сверхзвуковых аэродинамических трубах.
Гелий также применяется в качестве защитного газа в процессах дуговой сварки.
Химия — Кислород
Кислород является членом группы 16 в периодической таблице; однако, в большинстве случаев к нему относятся иначе, чем к его группе.
Символ кислорода — «О», а атомный номер — «8».
Кислород имеет около девяти аллотропов, и наиболее распространенным аллотропом является двухатомный кислород (т.е. O 2 ). Другим важным аллотропом является озон, то есть O 3 .
Кислород впервые был замечен шведским фармацевтом Карлом Вильгельмом Шееле.
Кислород характерно относится к группе «халькоген».
Слово «халькоген» происходит от греческого слова « khalkόs », что означает «медь», и латинского греческого слова « Genēs », что означает «рожден или произведен».
Кислород является высокореактивным газом (или неметаллическим элементом); следовательно, это окислитель, который легко образует оксиды с большинством элементов и соединений.
Кислород имеет шесть валентных электронов.
Температура плавления кислорода составляет -218,8 ° С, а температура кипения составляет -183 ° С.
С долей около 20,8% (в общем количестве составляющих атмосферы Земли), кислород является вторым элементом атмосферы Земли.
Кислород встречается практически в сфере Земли, а именно в атмосфере, гидросфере и литосфере.
Во время процесса фотосинтеза свободный кислород производится всеми зелеными растениями.
Кислород встречается в составе медных руд.
Организм человека содержит около 65 процентов кислорода.
По массе почти половина земной коры состоит из кислорода (то есть его оксидов).
По массе кислород является третьим по распространенности элементом во вселенной; первый и второй водород и гелий соответственно.
Кислород (то есть O 2 ) представляет собой двухатомный газ без цвета и запаха.
Кислород растворяется в воде очень легко; однако растворимость кислорода в воде зависит от температуры.
Ниже приведены основные соединения кислорода —
оксид
перекись водорода
Углекислый газ — CO 2
Гидроксид — ОН —
Озон — О 3
Ртуть (II) оксид — HgO
Хлорат — ClO 3
Оксид алюминия — Al 2 O 3
Угарный газ — CO
Гипохлорит — ClO —
Диоксид кремния — SiO 2
Гипофлуористая кислота — ХОФ
Перекись натрия — Na 2 O 2
Хлорат калия — KClO 3
Кислород дифторид — ОФ 2
Оксид натрия — Na 2 O
Кислород (O 2 ) является наиболее необходимым требованием для дыхания, без него невозможно представить жизнь.
Кислород используется в медицине.
Кислородная терапия обычно используется для лечения некоторых заболеваний, таких как эмфизема, пневмония, некоторые сердечные заболевания и т. Д.
Некоторые подводные занятия, такие как подводное плавание, подводные лодки и т. Д., Также используют искусственный кислород.
Самолеты, альпинисты и т. Д. Также используют искусственный кислород.
Кислород также используется в некоторых отраслях промышленности, например, при выплавке железной руды в сталь — в этом процессе используется около 55% кислорода.
Химия — Углерод
Углерод является неметаллическим и четырехвалентным элементом.
Четырехвалентное средство — углерод делает четыре электрона доступными для образования ковалентных химических связей.
Углерод имеет три изотопа, которые встречаются в природе, а именно 12 С, 13 С и 14 С.
Среди них 12 C и 13 C стабильны, но 14 C является радиоактивным изотопом. Период полураспада 14 C составляет около 5730 лет.
Физические свойства углерода в значительной степени зависят от его аллотропов.
Основными аллотропами углерода являются графит, алмаз и аморфный углерод.
Графит непрозрачный, черный и очень мягкий; следовательно, он имел обыкновение формировать полосу на бумаге.
Алмаз очень твердый (самый твердый природный материал) и прозрачный.
Графит является хорошим проводником электричества.
Алмаз плохой проводник электричества.
Углерод, скорее всего, имеет наивысшую точку сублимации среди всех элементов.
По массе углерод является четвертым наиболее распространенным химическим элементом во Вселенной (после водорода, гелия и кислорода).
Углерод доступен в изобилии на Солнце, в звездах, кометах и в атмосферах большинства планет.
Углерод находится в земной атмосфере и растворяется в воде.
Углеводороды, такие как уголь, нефть и природный газ, все они содержат углерод.
Углерод также содержится в гидратах метана, которые встречаются в полярных регионах и под морями.
Некоторые из обогащенных углеродом пород — это уголь, известняк, доломит и т. Д.
Уголь очень богат углеродом; следовательно, это самый большой коммерческий источник минерального углерода.
На долю угля приходится около 4000 гигатонн, или 80% всего ископаемого топлива.
Ниже приведены основные соединения углерода —
Cyanogen — CN 2
Цианистый водород — HCN
Цианамид — CN 2 H 2
Изоциановая кислота — HNCO
Цианоген хлорид — CNCl
Хлорсульфонилизоцианат — CNClO 3 S
Цианурхлорид — NCCl 3
Дисульфид углерода — CS 2
Карбонилсульфид — OCS
Моносульфид углерода — CS
В зависимости от allotrops углерод используется в различных областях применения.
Углерод является одним из самых важных элементов жизни без него, мы не можем представить жизнь на земле.
Ископаемое топливо, а именно метан и сырая нефть (нефть), уголь и т. Д., Используются в повседневной жизни.
Графит, в сочетании с глиной, используется для изготовления «свинца», используемого в карандашах.
Древесный уголь также используется в качестве материала для рисования в художественных работах, выплавке чугуна, барбекю и т.д.
Алмаз обычно используется в ювелирных изделиях.
Промышленные алмазы используются в режущих, сверлильных и полировальных инструментах для обработки металлов и камня.
Ископаемые углеводороды и углеродное волокно используются в производстве пластмасс.
Химия — Азот
Азот является химическим элементом группы 15 периодической таблицы; среди всех элементов группы 15 это самый легкий элемент.
Символ азота — «N», а атомный номер — 7 .
В 1772 году шотландский врач Даниэль Резерфорд впервые открыл и изолировал углерод.
Однако название «азот» впервые дал Жан-Антуан-Клод Шапталь в 1790 году.
Азот имеет два стабильных изотопа, а именно 14 N и 15 Н.
Свободные атомы азота обычно легко реагируют с большинством элементов и образуют нитриды.
Молекулы N 2 — это бесцветный, без запаха, без вкуса и диамагнитный газ в стандартных условиях.
Температура плавления N 2 составляет -210 ° С, а температура кипения составляет -196 ° С.
Соединения азота периодически обмениваются между атмосферой и живыми организмами, образуя азотный цикл.
Азот является наиболее распространенным элементом на Земле, так как он составляет около 78,1% от всего объема земной атмосферы.
Газообразный азот, который является промышленным газом, в основном получают путем фракционной перегонки жидкого воздуха.
Ниже приведены основные соединения азота —
Аммоний — NH 4+
Аммиак — NH 3
Азотная кислота — HNO 3
Нитрит — NO 2-
Диоксид азота — NO 2
Динитроген пентроксид — N 2 O 5
Гидразин — N 2 H 4
Динитроген — N 2
Цианид — CN
Аммиачная селитра — (NH 4 ) (NO 3 )
Трихлорид азота — NCl 3
Трифторид азота — NF 3
Трийодид азота — NI 3
Пиридин — C 5 H 5 N
Ион нитрония — NO 2+
Гидразойная кислота — HN 3
Сульфат аммония — (NH 4 ) 2 SO 4
Соединения азота широко используются в самых разных областях и отраслях промышленности.
Чистый азот используется в качестве пищевой добавки.
Используется в системах пожаротушения, особенно для оборудования информационных технологий.
Также используется в производстве нержавеющей стали.
Азот также используется для накачивания шин некоторых самолетов и гоночных автомобилей.
Жидкий азот используется в качестве хладагента.
Химия — Химическое право
Законы природы, связанные с химией, известны как химические законы.
Химические реакции, как правило, регулируются определенными законами, которые, соблюдаемые и сформулированные словами, становятся фундаментальными понятиями в химии.
Ниже приведены важные химические законы —
Химия — открытие элементов
Скорее всего, медь была первым элементом, который добывали и использовали люди.
Доказательства самого раннего использования меди были найдены в Анатолии, которая принадлежит 6000 г. до н.э.
Свинец, скорее всего, был вторым элементом, который люди начинают использовать.
Самым старым из известных артефактов свинца является статуэтка, найденная в храме Осириса, Абидос, Египет.
Статуэтка храма Осириса принадлежит (около) 3800 г. до н.э.
Самое старое из известных золотых сокровищ было обнаружено в Варне, некрополь (Болгария).
Это золотое сокровище принадлежит (около) 4 400 г. до н.э.
Открытие серебра почти так же, как золота; его доказательства были найдены в Малой Азии.
Некоторые данные говорят о том, что железо было известно с (около) 5000 г. до н.э.
Самые древние из известных железных предметов, которые использовались людьми, были найдены в Египте (принадлежит 4000 г. до н.э.).
Следующая таблица иллюстрирует важные элементы с датой их обнаружения и обнаруживает —
Химия — элементы с их валентностью
Следующая таблица иллюстрирует значимые элементы и их валентность —
Элементы с их атомным номером
Атомный номер определяет количество протонов, найденных в ядре элемента.
Общее количество протонов и нейтронов (найденных в ядре) рассчитывается как атомное массовое число.
В следующей таблице показаны некоторые значимые элементы с их атомным номером, атомной массой и символами.
Химия — Нобелевская премия
Якобус Хенрикус ван’т Хофф (ученый из Нидерландов) был первым, кто получил Нобелевскую премию по химии в 1901 году.
Якоб Хенрикус получил Нобелевскую премию за свою работу, а именно «законы химической динамики и осмотического давления в растворах».
Начиная с 1901 по 2016 год, всего 174 ученых (химиков) получили Нобелевскую премию.
К тому времени четыре женщины получили Нобелевскую премию по химии.
Мария Кюри была первой женщиной, получившей Нобелевскую премию по химии.
Следующая таблица иллюстрирует имена людей, которые получили Нобелевскую премию по химии вместе с их работой (за которую они получили премию) —