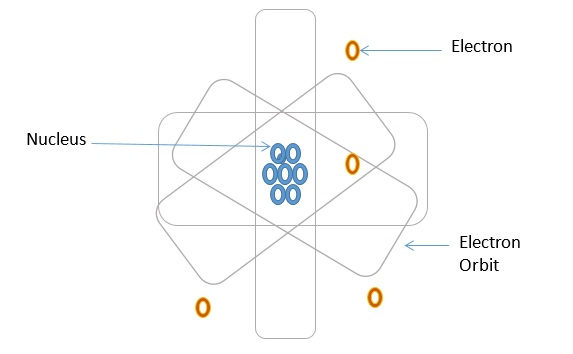
Все, что имеет вес, имеет значение. Согласно теории атома, все вещество, будь то твердое вещество, жидкость или газ, состоит из атомов. Атом содержит центральную часть, называемую ядром, которая содержит нейтроны и протоны. Обычно протоны являются положительно заряженными частицами, а нейтроны — нейтрально заряженными частицами. Электроны, которые являются отрицательно заряженными частицами, расположены на орбитах вокруг ядра способом, подобным массиву планет вокруг Солнца. На следующем рисунке показан состав атома.
Найдено, что атомы разных элементов имеют разное количество протонов, нейтронов и электронов. Чтобы отличить один атом от другого или классифицировать различные атомы, число, которое указывает число протонов в ядре данного атома, присваивается атомам каждого идентифицированного элемента. Этот номер известен как атомный номер элемента. Атомные номера для некоторых элементов, которые связаны с изучением полупроводников, приведены в следующей таблице.
| Элемент | Условное обозначение | Атомный номер |
|---|---|---|
| кремний | си | 14 |
| германий | Ge | 32 |
| мышьяк | Как | 33 |
| сурьма | Sb | 51 |
| Индий | В | 49 |
| галлий | Джорджия | 31 |
| бор | В | 5 |
Обычно атом имеет одинаковое количество протонов и планетарных электронов, чтобы поддерживать его суммарный заряд на нуле. Атомы часто объединяются, чтобы сформировать стабилизированные молекулы или соединения через их доступные валентные электроны.
Процесс объединения свободных валентных электронов обычно называется связыванием . Ниже приведены различные виды связей, которые имеют место в комбинациях атомов.
- Ионная связь
- Ковалентная связь
- Металлическое соединение
Давайте теперь обсудим подробно об этих атомных связях.
Ионная связь
Каждый атом стремится к стабильности, когда атомы связываются вместе, образуя молекулы. Когда валентная зона содержит 8 электронов, она называется стабилизированным состоянием . Когда валентные электроны одного атома объединяются с электронами другого атома, чтобы стать стабильными, это называется ионной связью .
-
Если атом имеет более 4 валентных электронов во внешней оболочке, он ищет дополнительные электроны. Такой атом часто называют акцептором .
-
Если какой-либо атом содержит менее 4 валентных электронов во внешней оболочке, они пытаются выйти из этих электронов. Эти атомы известны как доноры .
Если атом имеет более 4 валентных электронов во внешней оболочке, он ищет дополнительные электроны. Такой атом часто называют акцептором .
Если какой-либо атом содержит менее 4 валентных электронов во внешней оболочке, они пытаются выйти из этих электронов. Эти атомы известны как доноры .
При ионной связи донорные и акцепторные атомы часто объединяются вместе, и комбинация становится стабилизированной. Поваренная соль является распространенным примером ионной связи.
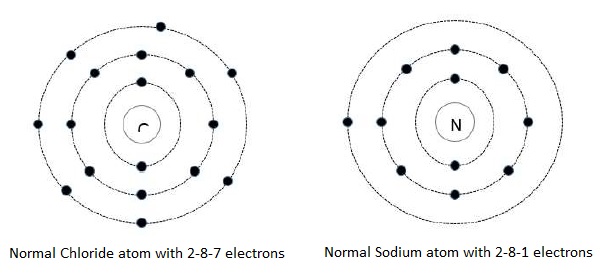
Следующие рисунки иллюстрируют пример независимых атомов и ионной связи.
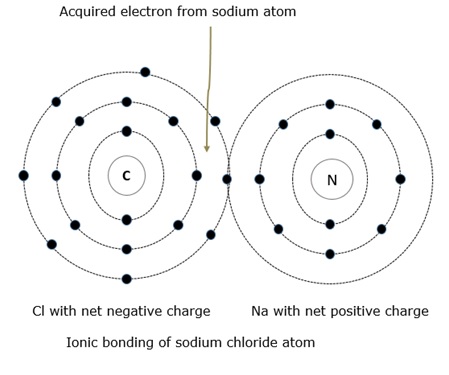
На приведенном выше рисунке видно, что атом натрия (Na) отдает свой 1 валентный электрон атому хлорида (Cl), который имеет 7 валентных электронов. Атом хлорида немедленно становится перебалансированным отрицательно, когда он получает дополнительный электрон, и это заставляет атом становиться отрицательным ионом. В то время как с другой стороны, атом натрия теряет свой валентный электрон, и тогда атом натрия становится положительным ионом. Как мы знаем, в отличие от притяжения зарядов, атомы натрия и хлорида связаны друг с другом электростатической силой.
Ковалентная связь
Когда валентные электроны соседних атомов делятся с другими атомами, происходит ковалентная связь. При ковалентной связи ионы не образуются. Это уникальное различие в ковалентной связи и ионной связи.
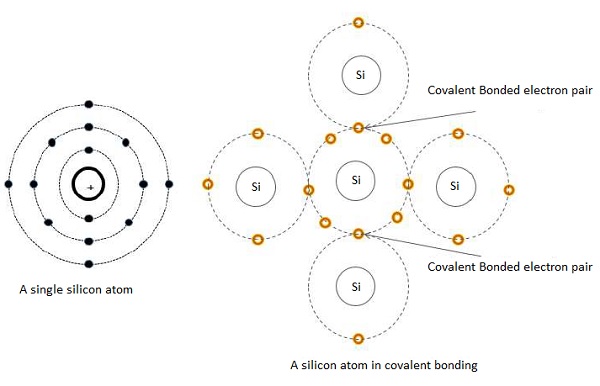
Когда атом содержит четыре валентных электрона во внешней оболочке, он может делить один электрон с четырьмя соседними атомами. Ковалентная сила устанавливается между двумя связывающими электронами. Эти электроны попеременно смещают орбиты между атомами. Эта ковалентная сила связывает отдельные атомы вместе. Иллюстрация ковалентной связи показана на следующих рисунках.
При таком расположении показаны только ядра и валентные электроны каждого атома. Электронная пара создается за счет того, что отдельные атомы связаны вместе. В этом случае, пять атомов необходимы для завершения связующего действия. Процесс склеивания расширяется во всех направлениях. Каждый атом теперь связан вместе в решетчатой сети, и кристаллическая структура образована этой решетчатой сетью.
Металлическое соединение
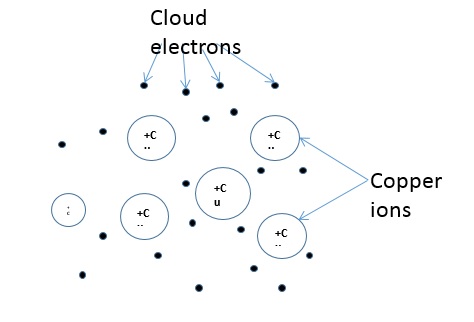
Третий тип соединения обычно имеет место в хороших электрических проводниках и называется металлическим соединением. При металлическом соединении между положительными ионами и электронами существует электростатическая сила. Например, валентная зона меди имеет один электрон в своей внешней оболочке. Этот электрон имеет тенденцию перемещаться вокруг материала между различными атомами.
Когда этот электрон покидает один атом, он мгновенно выходит на орбиту другого атома. Процесс повторяется без перерыва. Атом становится положительным ионом, когда электрон покидает его. Это случайный процесс . Это означает, что один электрон всегда связан с атомом. Это не означает, что электрон связан с одной конкретной орбитой. Это всегда роуминг на разных орбитах. Как следствие, все атомы, вероятно, разделяют все валентные электроны.
Электроны торчат в облаке, которое покрывает положительные ионы. Это парящее облако случайным образом связывает электроны с ионами. На следующем рисунке показан пример металлического соединения меди.